EL ESTADO GRASEOSO
3.1 SUSTANCIAS QUE EXISTEN COMO
GASES
Como se sabe estamos rodeados de aire cuya composición porcentual en volumen es de aproximadamente:
Oxígeno (O2) es vital para las plantas y los
animales.

Ozono (O3)
se forma en la atmosfera superior mediante la interacción del oxígeno con la
luz ultravioleta, absorbe parte de la radiación dañina antes de que puedan
golpear la superficie de la tierra.

Argón la
mayor parte del argón 40, producido por la desintegración radioactiva del
potasio 40en el manto y la corteza terrestre y desprendido a la atmosfera por
los volcanes.
Dióxido de Carbono (CO2)
el más importante de los gases, involucrado en un ciclo global. Se libera desde
el interior de la tierra.

Vapor
de Agua el aire tiene un
tipo de temperatura y cuando este se sobre pasa el vapor del agua se condensa y
cae el agua.
3.1.1 LA TEORÍA CINÉTICA DE LOS GASES
Esta teoría fue enunciada para justificar las propiedades y el comportamiento de los gases. La teoría cinética se desarrolló con base en los estudios de físicos como Daniel Benoulli en el siglo XVIII. Se basa en una serie de postulados que explican los hechos de experimentos observados; los postulados son los siguientes:
•Un
gas consiste de pequeñas partículas (átomos o moléculas) que se mueven
aleatoriamente con velocidades altas.
•Las
fuerzas atractivas entre las partículas de un gas por lo general son muy
pequeñas.
•El
volumen real ocupado por las moléculas de un gas es extremadamente pequeño
comparado con el volumen que ocupa el gas.
•La
energía cinética promedio de las moléculas de gas es proporcional a la
temperatura Kelvin.
La presión de un gas se refiere a la fuerza con que las moléculas empujan o chocan contra un área.
constante movimiento y se mueven rápidamente en trayectorias rectas.
3.1.2 COMPOSICIÓN DE LA ATMÓSFERA TERRESTRE

La capa exterior de la tierra es gaseosa, de composición y densidad muy distintas de las capas sólidas y líquidas que tiene debajo. Pero es la zona donde se desarrolla la vida.
Esta capa está formada por gases, los principales son:
Nitrógeno (N2)
78% total del aire. Es una gas que no reacciona casi con ninguna otra
sustancia (inerte) y apenas se disuelve en agua.
|
Oxigeno (O2)
21% del total. Es un gas muy reactivo, se combina con otras sustancias oxidándolas. Permite que
los combustibles ardan y se disuelvan en agua.
|
Dióxido de Carbono (CO2)
0.033% del total. Producido por la combustión de los combustibles fósiles y
la respiración de las plantas. Es soluble en agua.
|
Gases nobles: Argón
0.93%, Kriptón 0.000114%, Neón 0.00182, Helo 0.000524%.
|
Hidrogeno y Metano.
|
Vapor de Agua (H2O)
Se encuentra hasta en un 4%. Su proporción depende de la zona de la
superficie terrestre y de la temperatura atmosférica.
|
3.2 PRESIÓN DE UN GAS
Presión atmosférica: es el peso ejercido
por el aire en cualquier punto de la atmósfera. Dicha presión varia en la
tierra de acuerdo a la altitud, a mayor altitud, menor presión atmosférica.
Presión absoluta: presión real que se
ejerce sobre un punto dado.

3.2.2 MANOMÉTRICA
Es la presión relativa
que ejerce un fluido (líquido o gas), su valor depende de la presión externa.
La presión manométrica puede
tener un valor mayor o menor que la presión atmosférica. Un
manómetro que mide presiones inferiores a la atmosférica se llama manómetro de
vacío o vacuómetro. 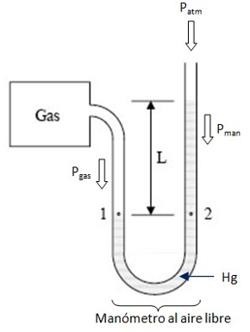

El manómetro es un tubo
de vidrio doblado en forma de “U” o forma de “J” con dos ramas,
conteniendo cierta cantidad de mercurio y que posee un codo en una de las ramas
para conectar al fluido que se le quiere medir la presión. La diferencia de
niveles del mercurio es lo que corresponde a la presión manométrica.
La presión
manométrica (Pman) la podemos expresar de dos formas, según
la unidad de presión que se desee:
Pman = ϒ(Hg) x L
donde Y(Hg)
es el peso especifico del mercurio.
También:
Pman = L cmHg
La presión
absoluta (total) del gas lo hallamos así:
Pgas = Pman +
Patm
La presión
manométrica en función de la presión absoluta y presión externa (atmosférica)
lo hallamos despejando:
Pman = Pgas -
Patm
En base a
esta formula, podemos observar que la Pman cambia al variar la
presión externa, debido a ello se dice que es relativa, si la presión externa
aumenta, la presión manométrica disminuirá; si la presión externa disminuye,
entonces la presión manométrica aumentará.
3.3 LEYES DE LOS GASES
Las primeras leyes de los gases fueron
desarrolladas desde finales del siglo XVII, cuando los
científicos empezaron a darse cuenta de que en las relaciones entre la presión, el volumen y la temperatura de
una muestra de gas, en un sistema cerrado, se podría obtener
una fórmula que sería válida para todos los gases.

3.3.1 LEY DE BOYLE
Relación
entre la presión y el volumen de un gas cuando la temperatura es constante.
Fue
descubierta por Robert Boyle en 1662.
Establece
que la presión de un gas en un recipiente cerrado, es inversamente proporcional
al volumen del recipiente, cuando la temperatura es constante.
Ejemplo:
Una
muestra de gas hidrogeno (H2) tiene un volumen de 5L y una presión
de 1 atm, ¿Cuál es la nueva presión si el volumen disminuye a 2L a temperatura constante?
P1 V1= P2V2
(Para
este problema debemos despejar “P2”) y como resultado tenemos 2.5
atm
3.3.2 LEY DE CHARLES
En 1787, Jack
Charles estudió por primera vez la relación entre el volumen de una
muestra de gas y observó que, a presión
constante, el volumen de una cantidad fija de un gas es directamente
proporcional a la temperatura absoluta.
Veamos un ejemplo:
Una muestra de gas neón tiene un volumen de 5.4L
y una temperatura de 150°C. Encuentra el nuevo volumen del gas después de que
la temperatura aumenta a 42°C a presión constante.
Respuesta:
5.9 Litros.
3.3.3 LEY DE GAY-
LUSSAC
Ley
enunciada por Josep Louis Gay-Lussac a principios de 1800. Establece que la presión de un volumen fijo de un gas, es directamente proporcional a su
temperatura. Esto ocurre porque al
aumentar la temperatura, las moléculas del gas se mueven más rápidamente y por
tanto aumenta el número de choques contra las paredes, es decir aumenta la
presión ya que el recipiente es de paredes fijas y su volumen no puede cambiar.
Veamos un ejemplo.
En un tanque se almacenan 20 litros de oxígeno a
una presión de 2 atm, es necesario
transportarlo a un lugar que tiene una temperatura de -10°C hasta otro lugar de
30°C ¿Qué presión debe soportar el tanque?
Datos.
3.3.4 LEY COMBINADA DE LOS GASES
 Todas las relaciones presión-volumen-temperatura para
los gases se pueden combinar en una sola relación llamada “ley de los gases
combinada”
Todas las relaciones presión-volumen-temperatura para
los gases se pueden combinar en una sola relación llamada “ley de los gases
combinada” Veamos un ejemplo.
Una burbuja de 25 ml se libera del tanque de
aire de un buzo a una presión de 4.00 atm y una temperatura de 11°C ¿Cuál es el
volumen (ml) de la burbuja cuando llega a la superficie del océano donde la
presión es de 1.o00 atm y la temperatura de 18°C?
Datos.
Respuesta: 102.46 ml
3.3.5 ECUACIÓN DE LOS
GASES IDEALES
Podemos expresar las leyes anteriores como una relación de
proporcionalidad:
Ley de Boyle, Ley de Charles y Ley de Avogadro
Si llamamos R a la constante de proporcionalidad, obtenemos:
V=R(nT/P)
o PV=nRT
Esta ecuación se conoce como la ecuación de los gases ideales. Un
gas ideal es un gas hipotético cuyo comportamiento de presión, volumen, y
temperatura se describe por completo mediante la ecuación del gas ideal. El
termino R se conoce como la constante de los gases y las unidades dependen de
las unidades de P, V, n y T, con T siempre en unidades de temperatura absoluta.

EJEMPLO:
1. El óxido dinitrogeno (N2O), que se usa en odontología
es un anestésico también llamado “gas de la risa”. ¿Cuál es la presión en
atmósferas de .350 moles de N2O a 22°C en un contenedor de 5 litros?
Primer paso: Conocer los datos que te dan.
n= 0.350 moles
T= 22° C
R= 0.082
V= 5 Litros
Segundo paso: Convertir °C a K (Kelvin)
22°C+273= 295 K
Tercer paso: Despejar la fórmula de acuerdo a lo que se quiere
conocer.
PV= nRT
-------------------------à P= nRT
V
Cuarto paso:
Sustituir datos en la fórmula ya despejada.
P= (0.350
mol)(0.082)(295K)
5
P= 1.69 atm
3.3.6 LEY DE DALTON DE LAS PRESIONES
PARCIALES
Esta ley dice: “la
presión total de una mezcla gaseosa es igual a la suma de las presiones
parciales de los gases que la componen”


3.4 APLICACIONES. PRESIÓN ATMOSFÉRICA Y LA PRÁCTICA
DEPORTIVA. EFECTO INVERNADERO E INVERSIÓN TERMICA.
GASES EN LA SANGRE
Nuestras células usan oxígeno y producen dióxido de
carbono continuamente. Ambos gases se mueven dentro y fuera de los pulmones a
través de las membranas de los alveolos, los pequeños sacos de aire en los
pulmones. Es un intercambio de gases donde el oxígeno del aire se distribuye en
los pulmones y en la sangre, mientras que el dióxido de carbono producido en
las células se va a los pulmones para exhalarlo.
GAS
|
AIRE INSPIRADO
|
AIRE ALVEOLAR
|
AIRE EXPIRADO
|
Nitrogeno
|
594
|
573
|
569
|
Oxigeno
|
160
|
100
|
116
|
Dioxido de Carbono
|
0.3
|
40
|
28
|
Vapor de agua
|
5.7
|
47
|
47
|
TOTAL
|
760
|
760
|
760
|
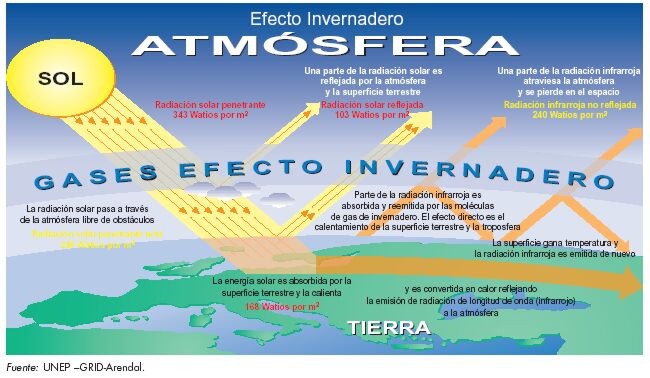
EFECTO INVERNADERO
Se llama efecto invernadero al fenómeno por el que
determinados gases componentes de una atmósfera planetaria retienen parte de la
energía que el suelo emite al haber sido calentado por la radiación solar.
Afecta a todos los cuerpos planetarios dotados de atmósfera. De acuerdo con el
actual consenso científico, el efecto invernadero se está acentuando en la
tierra por la emisión de ciertos gases, como el dióxido de carbono y el metano,
debido a la actividad económica humana. Este fenómeno evita que la energía del
sol recibida constantemente por la tierra vuelva inmediatamente al espacio
produciendo a escala planetaria un efecto similar al observado en un
invernadero.
SOLUCIONES:
·
Desconectar aparatos
electrónicos
·
Utilizar transporte
público
·
Utilizar electricidad
sólo cuando sea estrictamente necesario
·
Regulación de la
legislación ambiental
PRÁCTICA DEPORTIVA


Los atletas que asisten a eventos deportivos tienen un buen desempeño siempre
y cuando vivan en ciudades de altitud mayor o igual de la ciudad en la que
asisten. De acuerdo a la adaptación fisiológica del ser humano, se ha
estratificado a la atmósfera en tres zonas:
ZONA FISIOLÓGICA (De 0 a 3048 metros): Se caracteriza
porque el organismo humano puede vivir en esta zona con pequeñas adaptaciones
fisiológicas sin recurrir a medios externos o extraños a su organismo.
ZONA DEFICITARIA (De 3048 a 15240 metros): Zona en la cual el organismo humano no puede sobrevivir en forma definida
sin un aporte extraordinario de oxígeno.
ZONA EQUIVALENTE (Espacio de 15240 metros hacia arriba): Zona en que se requiere cabina presurizada y/o traje presurizado completo,
además del aporte de oxígeno extraordinario.







