4.1 EL PETRÓLEO Y SUS DERIVADOS
El petróleo se conoce desde la antigüedad: muchas civilizaciones del
medio oriente lo utilizaron; en las ceremonias religiosas y en medicina para
sanar lepra, las hemorragias, las enfermedades dentales, el reumatismo, las enfermedades
respiratorias, etc.
¿Sabías que…?
El
betún, por ejemplo ( Sustancia de
color negro compuesta de Carbono e Hidrógeno), fue
utilizado por las civilizaciones antiguas
en la fabricación de ladrillos para asegurar la impermeabilización de
las construcciones y los barcos.
|
PROCESO DEL FORMACIÓN DEL PETRÓLEO
En la naturaleza este
proceso se desarrolla durante muchas decenas de millones de años. La corteza
terrestre funciona, como un horno natural. La transformación ocurre sobre una sustancia
orgánica llamada Querógeno, que proviene de la lenta degradación de desechos
orgánicos llevada a cabo por bacterias anaeróbicas. Los desechos orgánicos
provienen de fitoplancton, de bacterias y eventualmente de plantas superiores
terrestres que se acumularon en los
sedimentos arcillosos de los fondos
lacustres o de mares cerrados y que
luego han quedado encerrados. En el “horno”, las enormes moléculas del
Querógeno se rompen, principalmente, en pequeñas moléculas de hidrocarburos y,
en menor proporción en diversas moléculas más complejas. A toda esta mezcla se
le llama “PETRÓLEO”
TEORÍA DE ENGLER SOBRE EL ORIGEN DEL PETRÓLEO
La
teoría de Adolf Engler (1911) propone tres etapas:
ETAPA
|
¿EN QUÉ
CONSISTE?
|
Primera
Etapa
|
Depósitos de
organismos de origen vegetal y animal se acumulan en el fondo de mares
internos (lagunas marinas). Las bacterias actúan, descomponiendo los
constituyentes carbohidratos en gases y materias solubles en agua, y de esta
manera son desalojados del depósito. Permanecen los constituyentes de tipo
ceras, grasas y otras materias estables, solubles en aceite.
|
Segunda
Etapa
|
A condiciones de alta presión y
temperatura se desprende CO2 de los compuestos con grupos carboxílicos, y H2O
de los ácidos hidroxílicos y de los alcoholes, dejando un residuo bituminoso.
La continuación de exposiciones a calor y presión provoca un craqueo ligero
con formación de olefinas (protopetróleo).
|
Tercer Etapa
|
Los
compuestos no saturados, en presencia de catalizadores naturales, se polimerizan
y ciclan para dar origen a hidrocarburos de tipo nafténico y parafínico. Que
es la teoría que actualmente tiene más aceptación de las Teorías Biogénicas.
|
4.1.1 COMPOSICIÓN QUÍMICA DEL PETRÓLEO
El Petróleo es una mezcla de hidrocarburos, que contienen en menor
proporción, otros elementos como: O,S, N e incluso metales como Ni, Fe y V. El número de átomos de carbono y
la forma en que están colocados dentro de las moléculas de los diferentes
compuestos, proporcionan al petróleo diferentes propiedades físicas y químicas.
Parafinas
|
Isoparafinas
|
Olefinas
|
Naftenos
|
Aromáticos
|
Las
cadenas lineales de carbono asociadas
a Hidrógeno.
|
Cadenas
ramificadas de carbono asociadas con Hidrógeno.
|
Cadenas
que contienen doble enlace entre los
átomos de carbono.
|
Moléculas
en las que se forman ciclos de carbono.
|
Ciclos
presentan dobles uniones alternas (anillo bencénico)
|
4.1.1 REFINACIÓN DEL PETRÓLEO
La refinación
del petróleo es un proceso
que incluye el fraccionamiento y transformaciones químicas del petróleo para producir derivados comercializables.
ETAPAS:
·
Destilación (Fraccionamiento): Dado que el petróleo crudo es
una mezcla de hidrocarburos con diferentes temperaturas de ebullición, que
pueden ser separados por destilación en grupos de hidrocarburos que hierven
entre dos puntos determinados de ebullición.
·
Reforma: La reforma es un proceso que
utiliza calor, presión y un catalizador (por lo general contiene platino) para
provocar reacciones químicas con naftas actualizar el alto octanaje de la
gasolina y como materia prima petroquímica.
·
Craqueo (Agrietamiento): En el refino
de petróleo los procesos de craqueo descomponen las moléculas de
hidrocarburos más pesados (alto punto de ebullición) en productos más ligeros
como la gasolina y el gasóleo.
·
Alquilación: Olefinas (moléculas y compuestos químicos) tales como
el propileno y el butileno son producidos por el craqueo catalítico y térmico.
Alquilación se refiere a la unión química de estas moléculas de luz con isobutano
para formar moléculas más grandes en una cadena ramificada (isoparafinas) que
se forma para producir una gasolina de alto octanaje.
·
Isomerización: La Isomerización se refiere a la reorganización
química de los hidrocarburos de cadena lineal (parafinas), por lo que contienen
ramificaciones unidas a la cadena principal (isoparafinas).
·
Polimerización: Bajo la presión y la temperatura, más un catalizador
ácido, las moléculas de luz de hidrocarburos insaturados reaccionan y se
combinan entre sí para formar moléculas más grandes de hidrocarburos. Este
proceso con los suministros
de petróleo se puede utilizar para reaccionar butenos con
iso-butanopara obtener una gasolina de alto octanaje.
PETRÓLEO CRUDO
GAS Y PETROQUÍMICOS BÁSICOS
PETROQUÍMICOS
4.2 HIDROCARBUROS
Una gran cantidad
de compuestos orgánicos se derivan de un
grupo de compuestos conocidos como hidrocarburos, debido a que están formados sólo pro carbono e
hidrógeno unidos por enlaces covalentes.
ESTRUCTURA DEL CARBONO
CONFIGURACIÓN
ELECTRÓNICA
4.2.1 ALCANOS
·
Hidrocarburos
saturados, es decir, compuestos de Carbono
e Hidrógeno unidos por enlaces sencillos.
·
Sus átomos
de carbono presentan hibridación sp3. Razón por la cual decimos que
tienen enlaces sencillos tipo σ.
·
Su fórmula
general en Cn H2n+2
·
Combustibles:
Los cuatro primeros alcanos son usados para propósitos de calefacción y cocina.
·
El metano y
el etano son los principales componentes del gas natural.
·
El propano
y el butano pueden ser líquidos a presiones moderadamente bajas y son conocidos como gases licuados.
·
Desde el
pentano hasta el octano los alcanos son líquidos razonablemente volátiles. Se
usan como combustibles en motores de
combustión interna.
·
Los
hidrocarburos de 9 a 16 átomos de carbono son líquidos de alta viscosidad y
forman parte del diesel y combustible de aviones.
·
Los alcanos
a partir del hexadecano en adelante constituyen los componentes más importantes
de los aceites lubricantes.
HIBRIDACIÓN sp3
La configuración electrónica desarrollada para
el carbono es:
El primer paso en la hibridación, es la promoción de un electrón del orbital
2s al orbital 2p.
Después de la promoción de la órbita sigue la mezcla de los orbitales
formándose 4 orbitales híbridos sp3 cada uno con un electrón.
Estos orbítales son idénticos entre sí, pero diferentes de los
originales ya que tienen características de los orbítales “s” y
“p”.combinadas. Estos son los electrones que se comparten. En este tipo de
hibridación se forman cuatro enlaces sencillos.
|
HIBRIDACIÓN sp4
En esta hibridación se
combinan solo dos orbitales “p” con un orbital “s”, formándose tres orbitales
híbridos sp2.
El átomo de carbono forma un enlace doble y dos
sencillos.
HIBRIDACIÓN sp
En este tipo de hibridación sólo se combina un
orbital “p” con el orbital “s”. Con
este tipo de hibridación el carbono puede formar un triple enlace.
GEOMETRÍA MOLECULAR
Geometría molecular tetraédrica: El carbono se encuentra en el centro de un
tetraedro y los enlaces se dirigen hacia los vértices.
Geometría triangular plana.- El carbono se encuentra en el centro de un triángulo. Se forma un doble
enlace y dos enlaces sencillos.
Geometría lineal.- Se
forman dos enlaces sencillos y uno triple.
4.5 APLICACIONES DE
LOS GRUPOS FUNCIONALES EN LA INDUSTRIA QUÍMICA Y FARMACEUTICA
ACANOS:
El propano y el butano pueden ser líquidos a
presiones moderadamente bajas y son conocidos como gases licuados del petróleo (GLP). Por ejemplo, el propano se usa en el
quemador de gas propano, el butano en los encendedores descartables de
cigarrillos. Estos dos alcanos son usados también como propelentes en
pulverizadores.
ALQUENOS:
ALQUINOS:
ALCOHOL:
ALDEHÍDOS:
·
La
fabricación de resinas
·
Plásticos
·
Solventes
·
Pinturas
·
Perfumes
·
Esencias
También se utiliza en la fabricación de
numerosos compuestos químicos como la baquelita, la melamina etc
CETONAS:
Principalmente, se los usa como
solventes orgánicos. Por ejemple la acetona se usaba como componente de los
quitaesmaltes. Además, cuando trabajas en laboratorios, se usan como
separadores de componentes en extracciones para identificar los componentes de una
mezcla. Y también son los solventes usados para corridas de HPLC
(cromatografías liquidas de alta performance), también para identificar
componentes de un producto.
ÁCIDO:
ÉTERES:
·
Medio
para extractar para concentrar ácido acético y otros ácidos.
·
Medio
de arrastre para la deshidratación de alcoholes etílicos e isopropílicos.
·
Disolvente
de sustancias orgánicas (aceites, grasas, resinas, nitrocelulosa, perfumes y
alcaloides).
·
Fuertes
pegamentos
ÉSTERES:
AMINAS:
Las aminas son parte de los
alcaloides que son compuestos complejos que se encuentran en las plantas.
Algunos de ellos son la morfina y la nicotina. Algunas aminas son
biológicamente importantes como la adrenalina y la noradrenalina. Las aminas
secundarias que se encuentran en las carnes y los pescados o en el humo del tabaco. Estas aminas pueden reaccionar
con los nitritos presentes en conservantes empleados en la alimentación y en plantas, procedentes del uso de fertilizantes,
originando N-nitrosoaminas secundarias, que son carcinógenas.
AMIDAS:
Las
amidas son comunes en la naturaleza, y una de las más conocidas es la urea, una
diamida que no contiene hidrocarburos. Las proteínas y los péptidos están
formados por amidas. Un ejemplo de poliamida de cadena larga es el nailon. Las
amidas también se utilizan mucho en la industria farmacéutica.
Aplicaciones
y usos
Las
amidas son comunes en la naturaleza y se encuentran en sustancias como los
aminoácidos, las proteínas, el ADN y el ARN, hormonas, vitaminas. Es
utilizada en el cuerpo para la excreción del amoníaco ( NH3). Muy utilizada en
la industria farmacéutica, y en la industria del nailon.
4.2.1.1
NOMENCLATURA DE ALCANOS
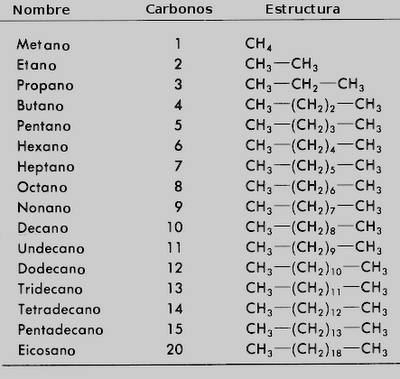
Para nombrar
alcanos, es necesario tomar en cuenta la siguiente tabla:
Dependiendo
del número de carbonos, se escribe el prefijo que le corresonda:
Prefijo+ terminación “ano”
Por ejemplo:
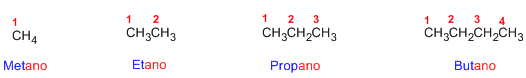
Regla 1. Se elige como cadena principal la
de mayor longitud. Si dos cadenas tienen
la misma longitud se toma como principal la más ramificada.
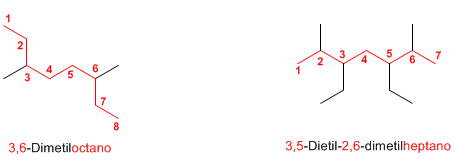
Regla
2.
La numeración parte del extremo más cercano a un sustituyente. Si por ambos lados hay sustituyentes a igual
distancia de los extremos, se tienen en cuenta el resto de sustituyentes del
alcano.

Regla 3. El nombre del alcano comienza
especificando los sustituyentes, ordenados alfabéticamente y precedidos de sus
respectivos localizadores. Para
terminar, se indica el nombre de la cadena principal.
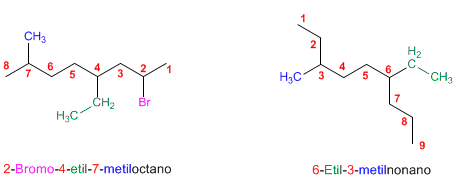
Regla 4.
Existen algunos sustituyentes con nombres comunes que conviene saber:
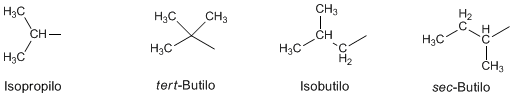
4.2.1.2 PROPIEDADES FÍSICAS Y QUÍMICAS DE LOS ALCANOS
PROPIEDADES
FÍSICAS
Ø Los
cuatro primeros alcanos de la serie homóloga
son gases a temperatura ambiente ( Metano, Etano, Propano y Butano), del
pentano al pentadecano son líquidos y
del hexadecano en adelante son sólidos.
 Ø Los
puntos de fusión y ebullición de los alcanos aumentan con el número de
carbonos de la molécula.
Ø Los
puntos de fusión y ebullición de los alcanos aumentan con el número de
carbonos de la molécula.
Ø Los
alcanos son solubles en disolventes
no polares como benceno, éter y cloroformo, e insolubles
en agua y otros disolventes fuertemente polares.
Ø La
densidad de los alcanos aumenta a mayor peso molecular, tiende a nivelarse en torno a 0.8 mg/ml, de
modo que todos ellos son menos densos que el agua.
PROPIEDADES
QUÍMICAS
ü A
temperatura ambiente, los alcanos no reaccionan es decir son inertes a la mayoría de los reactivos de
uso común.
ü La
propiedad química más importante es su
capacidad de entrar en combustión, es decir se oxidan con desprendimiento de
calor:
2 C4H10 + 9 O2
----------à
8 CO2 + 10 H2O
+ Energía Calorífica
ü Los
alcanos en presencia de luz pueden
reaccionar con el Cloro (Cl2 ) o con el Bromo ( Br2 ) originando alcanos halogenados:
CH4 + Cl2 ----------à CH3Cl +
HCl
ü En
la reacción de substitución un átomo de cloro substituye a un átomo de
hidrógeno. El Yodo no reacciona con los alcanos:
CH4 + I2 ----------à No hay reacción
4.2.1.3 APLICACIONES DE LOS ALCANOS EN LA VIDA COTIDIANA
- ü Los cuatro primeros alcanos son usados principalmente para propósitos de calefacción y cocina. El metano y el etano son los principales componentes del gas naturalü El propano y el butano pueden ser líquidos a presiones moderadamente bajas y son conocidos como gases licuados. Estos dos alcanos son usados también como propelentes en pulverizadores.ü Desde el pentano hasta el octano los alcanos son líquidos razonablemente volátiles. Se usan como combustibles en motores de combustión interna. Además de su uso como combustibles, los alcanos medios son buenos solventes para las sustancias no polares.ü Los hidrocarburos de 9 a 16 átomos de carbono son líquidos de alta viscosidad y forman parte del diesel y combustible de aviones.ü Los alcanos a partir del hexadecano en adelante constituyen los componentes más importantes de los aceites lubricantes4.2.2.1 NOMENCLATURA DE ALQUENOSRegla 1. Se escoge como cadena principal la más larga que contenga el doble enlace. De haber ramificaciones se toma como cadena principal la que contenga el mayor número de dobles enlaces, aunque sea más corta que las otras.
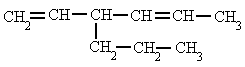 3-propil-1,4-hexadienoRegla 2. Se comienza a contar por el extremo más cercano a un doble enlace, con lo que el doble enlace tiene preferencia sobre las cadenas laterales a la hora de nombrar los carbonos, y se nombra el hidrocarburo especificando el primer carbono que contiene ese doble enlace.
3-propil-1,4-hexadienoRegla 2. Se comienza a contar por el extremo más cercano a un doble enlace, con lo que el doble enlace tiene preferencia sobre las cadenas laterales a la hora de nombrar los carbonos, y se nombra el hidrocarburo especificando el primer carbono que contiene ese doble enlace.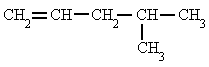 4-metil-1-pentenoRegla 3. En el caso de que hubiera más de un doble enlace se emplean las terminaciones, "-dieno", "-trieno", etc., precedidas por los números que indican la posición de esos dobles enlaces.
4-metil-1-pentenoRegla 3. En el caso de que hubiera más de un doble enlace se emplean las terminaciones, "-dieno", "-trieno", etc., precedidas por los números que indican la posición de esos dobles enlaces.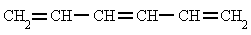 1,3,5-hexatrieno
1,3,5-hexatrieno

4.2.2.2 PROPIEDADES FISICAS DE LOS ALCANOS.
QUIMICAS
·
Los cuatro primeros
alcanos son gases a temperatura ambiente
(Metano, Etano, Propano y Butano), del pentano al pentadecano son líquidos y del hexadecano en
adelante son sólidos.
·
Los puntos de fusión
y ebullición de los alcanos aumentan con el número de
carbonos de la molécula.
·
Los alcanos son
solubles en disolventes no polares
como benceno, éter y cloroformo, e insolubles en agua y otros
disolventes fuertemente polares.
·
La densidad de los
alcanos aumenta a mayor peso molecular,
tiende a nivelarse en torno a 0.8 mg/ml, de modo que todos ellos son
menos densos que el agua.
FISICAS
·
A temperatura
ambiente, los alcanos no reaccionan es decir
son inertes a la mayoría de los reactivos de uso común.
·
La propiedad química
más importante es su capacidad de entrar
en combustión, es decir se oxidan con desprendimiento de calor:
2 C4H10 + 9 O2 8 CO2 +
10 H2O + Energía
Calorífica
·
Los alcanos en
presencia de luz pueden reaccionar con
el Cloro (Cl2 ) o con el Bromo ( Br2 ) originando alcanos halogenados:
CH4 + Cl2 CH3Cl +
HCl
·
En la reacción de
substitución un átomo de cloro substituye a un átomo de hidrógeno. El Yodo no
reacciona con los alcanos:
CH4 + I2
No hay reacción
4.2.2.3
APLICACIONES DE LOS ALQUENOS EN LA VIDA COTIDIANA
Uno de los principales compuestos de los alquenos es el
eteno CH2=CH2 y se encuentra en los gases procedentes del cracking de la
gasolina (la gasolina es una mezcla de hidrocarburos).

También
se emplea como anestésico general y como catalizador acelerando la maduración
de los plátanos, naranjas, papas, limones y otros.
Un
polímero muy importante es el polietileno que surge por polimerización del
etileno, el cual es un material muy útil en la actualidad. Puede ser un
plástico fuerte que se usa en tambores grandes, tubos, hasta biberones y
también puede ser suave que se usa desde embalaje de alimentos hasta pañales desechables.

4.2.3.1
NOMENCLATURA DE ALQUINOS
Regla 1. Los alquinos
responden a la fórmula CnH2n-2 y se nombran sustituyendo
el sufijo -ano del alca-no con
igual número de carbonos por -ino.
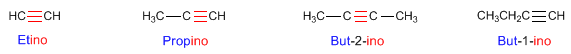
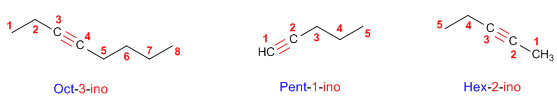
Regla 2. Se elige como cadena principal la de mayor longitud que contiene el triple enlace. La numeración debe otorgar los menores localizadores al triple enlace.
Regla 3. Cuando la molécula tiene más de un triple enlace, se toma como principal la cadena que contiene el mayor número de enlaces triples y se numera desde el extremo más cercano a uno de los enlaces múltiples, terminando el nombre en -diino, triino, etc.

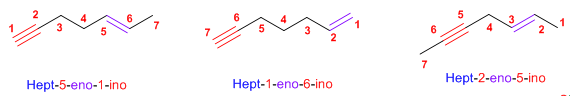
Regla 4. Si el hidrocarburo contiene dobles y triples enlaces, se procede del modo siguiente:
1. Se toma como cadena principal la que contiene al mayor número posible de enlaces múltiples, prescindiendo de si son dobles o triples.
2. Se numera para que los enlaces en conjunto tomen los localizadores más bajos. Si hay un doble enlace y un triple a la misma distancia de los extremos tiene preferencia el doble.
3. Si el compuesto tiene un doble enlace y un triple se termina el nombre en -eno-ino; si tiene dos dobles y un triple, -dieno-ino; con dos triples y un doble la terminación es, -eno-diino
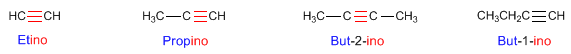
Regla 2. Se elige como cadena principal la de mayor longitud que contiene el triple enlace. La numeración debe otorgar los menores localizadores al triple enlace.

Regla 3. Cuando la molécula tiene más de un triple enlace, se toma como principal la cadena que contiene el mayor número de enlaces triples y se numera desde el extremo más cercano a uno de los enlaces múltiples, terminando el nombre en -diino, triino, etc.

Regla 4. Si el hidrocarburo contiene dobles y triples enlaces, se procede del modo siguiente:
1. Se toma como cadena principal la que contiene al mayor número posible de enlaces múltiples, prescindiendo de si son dobles o triples.
2. Se numera para que los enlaces en conjunto tomen los localizadores más bajos. Si hay un doble enlace y un triple a la misma distancia de los extremos tiene preferencia el doble.
3. Si el compuesto tiene un doble enlace y un triple se termina el nombre en -eno-ino; si tiene dos dobles y un triple, -dieno-ino; con dos triples y un doble la terminación es, -eno-diino

4.2.3.2 PROPIEDADES
QUIMICAS Y FISICAS DE LOS ALQUINOS
FISICAS
·
Son poco solubles en agua.
·
tienen una baja densidad y presentan bajos
puntos de ebullición.
·
Sin embargo, los alquinos son más polares
debido a la mayor atracción que ejerce un carbono sp sobre los electrones,
comparado con un carbono sp3 o sp2.
QUIMICAS
·
HIDROGENACIÓN: con hidrogeno y en presencia
de Pt, Ni o Pd, finamente dividido, se pueden adicionar dos moles de hidrogeno
el enlace triple para producir un alcano:
La hidrogenación es una reacción exotérmica y el calor
desprendido se ve afectado por sustituyentes de alquino, así los alquinos
internos desprenden menos calor al hidrogenarse que los terminales, debido a su
mayor estabilidad por el fenómeno de híperconjugación.
·
HALOGENACIÓN: el enlace triple es
menos susceptible de adicionar halógenos que el enlace doble, por eso cuando
existen en una molécula dos enlaces, uno doble y uno triple, puede lograrse la
adición del halógeno al enlace doble. además, por esta razón, la adición de
halógenos al enlace triple puede detenerse una vez formadoel dihaluro. de esta
manera, la bromación del acetileno puede conducir al derivado dihalogenuro o al
tetrahalogenuro, en presencia de cloruro férrico:
·
OXIDACIÓN: el enlace triple de un alquino
también puede oxidarse con permanganato de potasio o con ozono para producir
dos moléculas de acodos carboxílicos.
·
ADICIÓN DE ÁCIDO HALOGENADOS: Al igual que
los alquenos, la adición de ácidos clorhídrico, bromhídrico y yodhídrico,
cumple la regla de Markownikoff y conduce a la formación de un derivado
halogenado del alqueno o al dihalogenado del alcano:
·
IDENTIFICACIÓN DE UN TRIPLE ENLACE TERMINAL:
el triple enlace de un alquino terminal reacciona fácilmente con sodio, potasio
o amiduro de sodio, para formar precipitados conocidos como acetiluros
4.2.3.3
APLICACIONES DE LOS ALQUINOS EN LA VIDA COTIDIANA.
La mayor parte de los
alquinos se fabrican en forma de acetileno, el cual se utiliza como combustible
en la soldadura a gas por las altas temperaturas alcanzadas, también se
utilizan alquinos para la síntesis de PVC. También se pueden sintetizar
polímeros que se denominan poli alquinos, que son semiconductores orgánicos,
también se pueden encontrar alquinos en medicamentos llamados citostaticos, los
cuales son utilizados como medicamentos antineoplásicos, que son los que se
utilizan en las quimioterapias para personas que sufren de cáncer.
4.2.4
Hidrocarburos aromáticos.
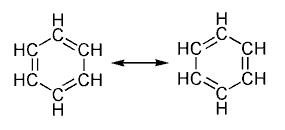
Los hidrocarburos aromáticos , son
hidrocarburos cíclicos, llamados así debido al fuerte aroma que
caracteriza a la mayoría de ellos, se consideran compuestos derivados del
benceno, pues la estructura cíclica del benceno se encuentra
presente en todos los compuestos aromáticos.
La estructura del benceno se caracteriza por:
La estructura del benceno se caracteriza por:
·
Es una estructura cerrada con forma
hexagonal regular, pero sin alternancia entre los enlaces simples y los dobles
(carbono-carbono).
·
Sus seis átomos de carbono son
equivalentes entre sí, pues son derivados mono sustituidos, lo que les hace ser
idénticos.
·
La longitud de enlace entre
los carbonos vecinos entre sí son iguales en todos los casos. La distancia es
de 139 pm, no coincidiendo con la longitud media de un doble enlace, que es de
133 pm, ni siquiera a la de un enlace simple, que es de 154 pm.
·
Los átomos de carbono del benceno,
poseen una hibridación sp^2, en tres de los orbitales atómicos, y estos son
usados para poder unirse a los dos átomos de carbono que se
encuentren a su lado, y también a un átomo de hidrógeno.
·
El orbital p (puro) de cada carbono
restante, se encuentra orientado perpendicularmente al plano del anillo de
hexágono, éste se solapa con los demás orbitales tipo p de los carbonos
contiguos. Así, los seis electrones deslocalizados formarán lo que se conoce como,
nube electrónica (π), que se colocará por encima, y también por debajo del
plano del anillo.
·
La presencia de la nube electrónica de
tipo π, hace que sean algo más pequeños los enlaces simples entre los carbonos
(C-C), otorgando una peculiar estabilidad a los anillos aromáticos.
4.2.4.1
Nomenclatura de hidrocarburos aromáticos mono sustituidos.
Se nombran
terminando el nombre del sustituyente en benceno.

Algunos derivados mono sustituidos del benceno
tienen nombres comunes ampliamente aceptados. Como en los compuestos
alifáticos, utilizamos comas para separar números y guiones para separar
números y palabras.

En bencenos di sustituidos se emplean los prefijos orto (benceno
1,2-disustituido), meta (benceno 1,3-disustituido) y para (benceno
1,4-disustituido) para indicar la posición de los sustituyentes en el anillo.
4.2.4.2
Aplicaciones de los compuestos aromáticos.
La
importancia económica de los hidrocarburos aromáticos ha aumentado
progresivamente desde que a principios del siglo XIX se utilizaba la nafta de
alquitrán de hulla como disolvente del caucho. En la actualidad, los
principales usos de los compuestos aromáticos como productos puros son: la
síntesis química de plásticos, caucho sintético, pinturas, pigmentos,
explosivos, pesticidas, detergentes, perfumes y fármacos. También se utilizan,
principal mente en forma de mezclas, como disolventes y como constituyentes, en
proporción variable, de la gasolina.

4.3 Grupos funcionales.

4.3.1 Alcoholes, éteres aldehídos y cetonas
ALCOHOLES: Se forman cuando se sustituyen
en los hidrocarburos uno o más átomos de hidrogeno por uno o más grupos
oxidrilo (-OH) por lo que la función alcohólica es –OH y su representación es R-OH.
Para nombrar un alcohol como primer paso
contamos el número de carbonos que hay y le asignamos su prefijo:
CH3-CH2-OH
 Como tiene dos
carbonos le corresponde el prefijo ”Et”
y su terminación siempre será:
“anol”. Así que el compuesto se llama: “Etanol”
Como tiene dos
carbonos le corresponde el prefijo ”Et”
y su terminación siempre será:
“anol”. Así que el compuesto se llama: “Etanol”
Sus propiedades fiscas son:
v Son
líquidos e incoloros.
v Tienen
un olor agradable cuando son puros.
v Sus
puntos de ebullición aumentan al aumentar el número de carbonos que tenga la
cadena.
v Los
alcoholes de C1 a C4, son líquidos solubles en agua, los
C5 a C12 son líquidos aceitosos, los C13son
sólidos.
v Presentan
puente de hidrogeno.
ETERES:
Están
unidos dos radicales alquinos a un oxigeno si los radicales son iguales se
forman éteres simples.
Para nombrar a los éteres se toma en cuenta el
número de carbonos que hay antes del oxígeno y se pone su prefijo que le
corresponde.
CH3-O-CH2-CH3
 Se pone
la palabra “oxi” y al final se cuentan los carbonos después del oxígeno y se
pone el prefijo que le corresponde junto con el sufijo “ano”; ya que es un
alcano. A este éter le corresponde el
nombre de : “Metoxietano”
Se pone
la palabra “oxi” y al final se cuentan los carbonos después del oxígeno y se
pone el prefijo que le corresponde junto con el sufijo “ano”; ya que es un
alcano. A este éter le corresponde el
nombre de : “Metoxietano”
Sus propiedades físicas son:
v Se
consideran derivados del agua o alcoholes, en los que se han remplazado uno o
dos hidrógenos respectivamente, por estos carbonos.
v No
puede establecer enlaces de hidrogeno consigo mismo sus puntos de ebullición
son bajos.
Sus propiedades químicas son:
v Tienen
muy poca reactividad química. Se utilizan como disolventes inertes en
reacciones orgánicas.
v Con
el aire sufren una lenta oxidación en la que se forman peróxidos inestables y
poco volatines
v Provocan
explosiones.
 ALDEHIDOS:
Se consideran
productos de la oxidación de alcoholes primarios. Se forman cuando un grupo
funcional de los alcoholes primarios se eliminan dos átomos de hidrogeno. Su
grupo funcional es –CH=O, se representa: R-CHO.
ALDEHIDOS:
Se consideran
productos de la oxidación de alcoholes primarios. Se forman cuando un grupo
funcional de los alcoholes primarios se eliminan dos átomos de hidrogeno. Su
grupo funcional es –CH=O, se representa: R-CHO.
Para nombrar un
aldehído se cuenta el número de carbonos que tiene y se le asigna su prefijo y
al final solo se agrega el sufijo “anal”

A
este aldehído le corresponde el nombre de: “Metanal”
Sus propiedades
físicas son:
v Tienen
hasta cuatro átomos de carbono, son solubles en agua. Se pierde la solubilidad
cuando hay más de siete carbonos.
v Son
menos densos en el agua.
v El
metanal es gaseoso, del etanol en adelante son líquidos.
Sus propiedades
químicas son:
v Se
hidrogenan y se convierten en alcoholes.
v Reaccionan
intensamente con halógenos (Cl y Br), un Br sustituye un hidrogeno del grupo
funcional –CHO.
v El
metanal es el aldehído más sencillo, se usa para fabricar polímeros. Es un gas
toxico soluble en agua.
CETONAS:
Se
producen por la oxidación leve de alcoholes secundarios, su grupo funcional es
el carbonilo.
 Para
nombrarlas se toma en cuenta el número de carbonos y el número donde se
encuentra el doble enlace. Se pone el prefijo dependiendo de los carbonos, y el sufijo “ona”
Para
nombrarlas se toma en cuenta el número de carbonos y el número donde se
encuentra el doble enlace. Se pone el prefijo dependiendo de los carbonos, y el sufijo “ona”
Esta
cetona es llamada 2-Pentanona.
Sus
propiedades físicas son:
v Las
primeras tienen un olor agradable.
v Si
contienen diez carbonos son liquidas. Con más de diez son sólidas.
v Las
alifáticas son de todos, menos densas que el agua.
4.3.2 Ácidos carboxílicos y esteres
ACIDOS
CARBOXILICOS: Tienen el mismo carbono que
el grupo carbonilo y un hidroxilo.
Sus propiedades
físicas son:
v Los
primeros tres son líquidos y de olor punzante, sabor acido, solubles en agua.
Del carbono C4 al C9 son aceitosos y huelen mal. A partir
del C10 son inodoros e insolubles en agua.
v Todos
son solubles en alcohol y éter.
v El
punto de ebullición aumenta de 18 a 19° por cada carbono.
Sus propiedades
químicas:
v Son
ácidos débiles que se hallan disociados en solución. Lo acido disminuye con el
número de carbonos. Reacciona con metales alcalinos y alcalinotérreos para
formar sales. Con los alcoholes forma esteres. Al combinarse con el amoniaco
forman amidas.
 ESTERES: Se forman por
reacción entre un ácido y un alcohol. Se producen con la pérdida del agua. El
agua se forma a partir del OH del ácido y el H del alcohol. Este proceso se
llama esterificación.
ESTERES: Se forman por
reacción entre un ácido y un alcohol. Se producen con la pérdida del agua. El
agua se forma a partir del OH del ácido y el H del alcohol. Este proceso se
llama esterificación.
Sus propiedades
físicas:
v Los
de bajo peso molar son líquidos de olor agradable. Los esteres de ácidos
superiores son sólidos, cristalinos, inodoros, solubles en solventes orgánicos
e insolubles en agua.
4.3.3 Aminas
y amidas
 AMINAS:
Compuestos que derivan del amoniaco NH3, hay de tres tipos:
Primarias, Secundarias y Terciarias.
AMINAS:
Compuestos que derivan del amoniaco NH3, hay de tres tipos:
Primarias, Secundarias y Terciarias.
Para nombrarlas, se
cuentan los carbonos, se le pone el prefijo predicho y la terminación “amina”
CH3-NH3
Esta amina es
primaria y es llamada: “Metilamina”
AMIDAS:
Son compuestos nitrogenados, que al igual que los esteres son derivados de los ácidos
carboxílicos.
Para nombrar una amida primaria
se cuenta el número de carbonos y se le agrega la terminación “anamida”

Se forman con los halógenos
(Cl, Br, I, F y At)
Su nomenclatura es muy sencilla,
al principio se pone el nombre del halogeno, despues se pone el prefijo
dependiendo del numero de carbonos y al final la terminacion “ano”
Cl-CH2-CH2-CH3
Este halogenuro es llamado “Cloro
Propano”
No se encuentran en los productos naturales, pero se obtienen en la destilación destructiva de sustancias naturales complejas, como el carbón, y en
grandes cantidades en las refinerías de petróleo, especialmente en el proceso de craqueo. Están relacionados con los hidrocarburos complejos del caucho o hule natural y son importantes en la fabricación de caucho y plásticos sintéticos. Son miembros importantes de esta serie el butadieno, C4H6, y
el isopreno, C5H8. El uso más común de los alcanos es gas butano gas LP,
metano, gasolina, parafinas, aceite de pino el natural, y la cera de abeja.
Los alcoholes tienen una gran gama
de usos en la industria y en la ciencia como disolventes y combustibles. El etanol y el metanol pueden hacerse
combustionar de una manera más limpia que la gasolina o el gasoil. Por su baja
toxicidad y disponibilidad para disolver sustancias no polares, el etanol es
utilizado frecuentemente como disolvente en fármacos, perfumes y en esencias
vitales como la vainilla. Los alcoholes sirven frecuentemente como versátiles
intermediarios en la síntesis orgánica.
Los ácidos son usados como catalizadores; por ejemplo,
el ácido sulfúrico es usado en grandes cantidades en el proceso de alquilación
para producir gasolina. Los ácidos fuertes, como el ácido sulfúrico, fosfórico
y clorhídrico, también tienen efecto en reacciones de deshidratación y
condensación. Los ácidos son usados también como aditivos en bebidas y alimentos, puesto que alteran su sabor y sirven como preservantes. Por ejemplo,
el ácido fosfórico es un componente de las bebidas con cola.
Muchos ésteres tienen un aroma característico, lo que
hace que se utilicen ampliamente como sabores y fragancias artificiales. Como
aromatizantes con olores a frutas, tales como manzanas, peritas, etc. También
se usan en la síntesis de otros compuestos tales como ácidos , y jabones
4.5 APLICACIONES DE
LOS GRUPOS FUNCIONALES EN LA INDUSTRIA QUÍMICA Y FARMACEUTICA
ACANOS:
El propano y el butano pueden ser líquidos a
presiones moderadamente bajas y son conocidos como gases licuados del petróleo (GLP). Por ejemplo, el propano se usa en el
quemador de gas propano, el butano en los encendedores descartables de
cigarrillos. Estos dos alcanos son usados también como propelentes en
pulverizadores.
ALQUENOS:
ALQUINOS:
ALCOHOL:
ALDEHÍDOS:
·
La
fabricación de resinas
·
Plásticos
·
Solventes
·
Pinturas
·
Perfumes
·
Esencias
También se utiliza en
la fabricación de numerosos compuestos químicos como la baquelita, la melamina
etc.
CETONAS:
Principalmente, se los usa como solventes orgánicos.
Por ejemple la acetona se usaba como componente de los quitaesmaltes. Además,
cuando trabajas en laboratorios, se usan como separadores de componentes en
extracciones para identificar los componentes de una mezcla. Y también son los
solventes usados para corridas de HPLC (cromatografías liquidas de alta
performance), también para identificar componentes de un producto.
ÁCIDO:
ÉTERES:
·
Medio
para extractar para concentrar ácido acético y otros ácidos.
·
Medio
de arrastre para la deshidratación de alcoholes etílicos e isopropílicos.
·
Disolvente
de sustancias orgánicas (aceites, grasas, resinas, nitrocelulosa, perfumes y
alcaloides).
·
Fuertes
pegamentos
ÉSTERES:
AMINAS:
Las aminas son parte de los
alcaloides que son compuestos complejos que se encuentran en las plantas.
Algunos de ellos son la morfina y la nicotina. Algunas aminas son
biológicamente importantes como la adrenalina y la noradrenalina. Las aminas
secundarias que se encuentran en las carnes y los pescados o en el humo del tabaco. Estas aminas pueden reaccionar
con los nitritos presentes en conservantes empleados en la alimentación y en plantas, procedentes del uso de fertilizantes,
originando N-nitrosoaminas secundarias, que son carcinógenas.
AMIDAS:
Las
amidas son comunes en la naturaleza, y una de las más conocidas es la urea, una
diamida que no contiene hidrocarburos. Las proteínas y los péptidos están
formados por amidas. Un ejemplo de poliamida de cadena larga es el nailon. Las
amidas también se utilizan mucho en la industria farmacéutica.
Aplicaciones
y usos
Las
amidas son comunes en la naturaleza y se encuentran en sustancias como los
aminoácidos, las proteínas, el ADN y el ARN, hormonas, vitaminas. Es
utilizada en el cuerpo para la excreción del amoníaco ( NH3). Muy utilizada en
la industria farmacéutica, y en la industria del nailon.